Exercícios sobre velocidade das reações (com gabarito explicado)
A velocidade das reações químicas é um dos temas centrais da cinética química. Entender os fatores que influenciam essa velocidade — como temperatura, concentração dos reagentes, superfície de contato e presença de catalisadores — é fundamental para interpretar e controlar processos químicos, tanto em laboratórios quanto em aplicações industriais e biológicas.
Neste conjunto de exercícios com gabarito comentado, você poderá revisar conceitos essenciais da cinética, interpretar gráficos, analisar mecanismos reacionais e aplicar seu conhecimento a situações do cotidiano e de provas. Ideal para quem quer fixar o conteúdo de forma prática e contextualizada.
Questão 1
Um químico está estudando a reação entre zinco metálico e ácido clorídrico:
Para isso, ele realizou a montagem de um aparato que permitisse a ele determinar o volume de gás hidrogênio produzido na reação mergulhando uma proveta completamente cheia de água em uma cuba com água. Assim, ao se realizar a reação em um tubo tampado, todo o gás liberado pôde ser transferido através de uma mangueira ligada ao tubo com uma saída dentro da proveta:
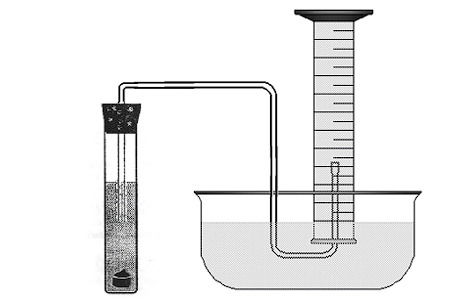
Foram realizados 3 experimentos, cada um com 2 tubos diferentes, alterando-se a temperatura, a forma do zinco metálico e a concentração da solução ácida. O tempo de análise foi o mesmo para todos os tubos e os dados estão na tabela:
| Experimento | 1 | 2 | 3 |
| Tubo 1 | T = 10ºC | zinco em pó | CHCl = 1mol/L |
| Tubo 2 | T = 20ºC | zinco em escamas | CHCl = 2mol/L |
Para se obter um maior volume de gás possível utilizando os tubos do procedimento realizado, qual combinação deve ser feita?
a) Experimento 1: tubo 2; Experimento 2: tubo 2; Experimento 3: tubo 2
b) Experimento 1: tubo 1; Experimento 2: tubo 2; Experimento 3: tubo 2
c) Experimento 1: tubo 2; Experimento 2: tubo 1; Experimento 3: tubo 2
d) Experimento 1: tubo 2; Experimento 2: tubo 2; Experimento 3: tubo 1
e) Experimento 1: tubo 1; Experimento 2: tubo 1; Experimento 3: tubo 1
Resposta: alternativa C.
Como queremos o maior volume de gás, em um mesmo período de tempo, precisamos otimizar as condições que favorecem a ocorrência da reação, deixando-a mais rápida e formando mais produto em menos tempo. Dessa forma, sabemos que à temperatura, concentração de reagentes e superfície de contato de reagente mais altos, a velocidade das reações aumenta. Assim, a combinação seria proveniente de uma temperatura maior (20ºC), de uma superfície de contato maior (pó) e concentração maior (2mol/L).
Questão 2
Gabriel está discutindo sobre a cinética de uma reação estudada em uma aula de laboratório. Reunindo-se os dados da reação, foram obtidos os seguintes resultados:
| Substância / Experimento | A / mol.L-1 | B / mol.L-1 | C / mol.L-1 | velocidade / mol.L-1.s-1 |
| 1 | 1,0 | 1,0 | 1,0 | 0,5 |
| 2 | 2,0 | 1,0 | 1,0 | 0,5 |
| 3 | 2,0 | 2,0 | 1,0 | 0,7 |
| 4 | 2,0 | 2,0 | 2,0 | 0,7 |
Após análise dos dados da tabela, Gabriel afirma que A não pode ser utilizado como catalisador desta reação. Assinale a alternativa correta:
a) Gabriel está certo, pois alterando a concentração de A não ocorre mudança na velocidade da reação.
b) Gabriel está certo, pois ao alterar a concentração dos outros reagentes a velocidade muda pouco.
c) Gabriel está errado, pois A não participa da reação e portanto sua concentração é irrelevante.
d) Gabriel está errado, pois como a velocidade da reação não é alterada com a alteração da concentração de A, isso indica que A não participa da reação.
e) Gabriel está errado, pois ao aumentarmos a concentração de A, a velocidade da reação aumenta.
Resposta: alternativa A.
A partir dos experimentos 1 e 2, vemos que alterando a concentração de A e mantendo a concentração das outras substâncias constantes, a velocidade não muda. Isso indica que A não interfere na cinética da reação e, mesmo sendo catalisador, aumentar sua concentração deveria acelerar a reação.
Leia o texto a seguir para responder às questões 3 e 4:
Catalisadores são utilizados para acelerar as reações, mas diferente do que muitos pensam, eles não diminuem a energia total necessária para a ocorrência de uma reação, mas apenas modifica o seu mecanismo, tornando as energias de ativação de cada etapa do mecanismo, mais acessíveis. Para uma reação genérica R -> P, obteve-se o seguinte gráfico:

Questão 3
As curvas observadas tratam de 2 experimentos feitos, com e sem a presença de catalisador. Baseado no gráfico, assinale a alternativa que apresenta o mecanismo correto da reação de formação de P a partir de R.
a)
b)
c)
d)
e)
Resposta: alternativa B.
Pela forma do gráfico podemos ver que o reagente é R e o produto é P. Além disso, as curvas que formam um vale em I representam uma reação que converte R em P com a utilização de um catalisador. Podemos então concluir que antes de R formar P, ele precisa formar um intermediário I que posteriormente será convertido em P:
Questão 4
Considerando a teoria do complexo ativado, determine qual deve ser o esboço da(s) estrutura(s) do(s) complexo(s) formado(s) na reação catalisada.
a)
b)
c)
d)
e)
Resposta: alternativa E.
A reação catalisada tem como resultado a curva com dois picos no gráfico mais abaixo. Assim, os estados de transição (complexos ativados) são E1 e E2. Sabemos que o complexo ativado representa uma estrutura intermediária entre a substância inicial e a substância final. Assim, E1 = R--I e E2 = I--P.
Questão 5
Enzimas são biomoléculas essenciais para à vida. Em geral, são proteínas que desempanham funções vitais como facilitar a ocorrência de reações que os organismos não conseguem fazer por si só sem a sua presença.
Um conceito na bioquímica muito importante é o de Alosteria que explica a mudança na conformação de enzimas através da ligação destas com ligantes diferentes, ativando ou inativando as enzimas. Um exemplo de enzima é a fosfofrutoquinase-1 (PFK-1), que regula a velocidade da glicólise, uma via metabólica que converte glicose em ATP. Existem inibidores e ativadores desta enzima para diferentes momentos de uma célula. Quando há necessidade de se produzir energia na célula, o ligante F2,6BP apresenta concentração mais alta na célula, se liga à PFK-1 e a enzima é ativada para a ocorrência da glicólise. Porém, quando há ATP suficiente na célula, ele se liga à PFK-1 e inativa esta enzima, impedindo que ocorra glicólise.
Considerando uma situação em que uma célula tenha muita glicose e muito ATP, assinale a alternativa correta
a) A glicólise será acelerada pela alta concentração de glicose.
b) A glicólise será interrompida, levando a um acúmulo de glicose.
c) A glicólise será acelerada pela alta concentração de ATP.
d) A glicólise será interrompida, levando a um acúmulo de ATP.
e) A glicólise será acelerada, levando a um acúmulo de ATP.
Resposta: alternativa B.
A glicólise pode ser simplificada como:
Considerando o momento em que há alta concentração de ATP, sabemos que a célula não necessita de energia. Dessa forma, a enzima PFK-1 é ligada ao ATP que realiza a inativação desta enzima e bloqueia a glicólise. Como a concentração de glicose é alta, também ocorre um acúmulo de glicose.
Questão 6
Reações químicas nem sempre são elementares, ou seja, não ocorrem em apenas uma etapa. Quando uma reação nos é apresentada, ela representa um processo que muitas vezes tem varias etapas, que conhecemos como mecanismo. Para conhecermos alguns comportamentos mais instrínsecos da reação, podemos recorrer ao mecanismo para ter noção de quais substâncias são formadas além daquelas que vemos na reação simplificada.
Uma reação genérica de A e B formando C e D, apresenta o seguinte mecanismo:
Sabendo que as etapas 2 e 3 são rápidas, determine a lei de velocidade desta reação.
a) v = k[A]2
b) v = k[A].[B]
c) v = k[A]2.[B]
d) v = k[A].[B]2
e) v = k[B]
Resposta: alternativa A.
Como a etapa lenta é a etapa 1, esta será a etapa determinante da cinética dessa reação. Assim, os reagentes dessa etapa serão os reagentes fundamentais para a lei de velocidade. Como só há o reagente A, com 2 mol na reação (do coeficiente), a lei de velocidade terá como cara v = k.[A]2. Observe que B, mesmo sendo reagente, não faz parte da lei de velocidade da reação, pois ele não aparece na etapa lenta.
Questão 7
O permanganato (MnO4-), íon de coloração violeta, é uma substância fortemente oxidante utilizada em laboratórios de Química para determinações quantitativas. Também foi utilizado por muito tempo como agente antimicrobiano em banhos de crianças com varicela (catapora), afim de evitar complicações pelo surgimento de outros micro-organismos. Uma forma de determinar a concentração desse íon em soluções é por meio de uma reação com oxalato (C2O42-), reação essa que necessita de um aquecimento inicial.
Com o progresso da reação, o aquecimento deixa de ser necessário, pois a reação passa se autocatalisar, ficando mais rápida. Assinale a alternativa que explica corretamente esse fenômeno:
a) A presença de ácido se torna mais significante.
b) Ocorre produção de Mn2+ que catalisa a reação.
c) Ocorre formação de CO2 que catalisa a reação.
d) O aquecimento deixa as substâncias aquecidas por bastante tempo.
e) A concentração de MnO4- aumenta e acelera a reação.
Resposta: alternativa B.
Como a reação forma íons Mn2+, este íon catalisa a reação aumentando sua velocidade. Outra resposta que poderia ser plausível neste sentido seria a C, no entanto, o CO2 formado é gasoso e escapa da solução, não podendo catalisar a reação. Além disso, íons metálicos costumam ser bons catalisadores, diferente de gases dessa espécie.
Estude mais lendo Cinética química: velocidade, influência de fatores e exercícios e continue praticando com Exercícios sobre cinética química.
Exercícios sobre velocidade das reações (com gabarito explicado). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-velocidade-das-reacoes-com-gabarito-explicado/. Acesso em:

