Exercícios sobre pilhas (com gabarito resolvido)
Confira os exercícios resolvidos sobre pilhas, com explicações detalhadas que facilitam a compreensão dos conceitos teóricos e práticos. As questões abordam temas como agentes redox, potenciais-padrão, representação de pilhas e o uso de metais de sacrifício. Aproveite para testar seus conhecimentos e aprofundar seu aprendizado com o auxílio das resoluções comentadas.
Questão 1
Uma pilha comum de lanterna é composta por zinco (ânodo) e dióxido de manganês (cátodo) em meio alcalino. Durante o funcionamento da pilha, ocorre a seguinte semi-reação no ânodo:
Zn(s) + 2OH⁻(aq) → ZnO(s) + H2O(l) + 2e⁻
Qual das alternativas descreve corretamente o processo no cátodo dessa pilha?
a)
b)
c)
d)
Resposta: alternativa A.
A única alternativa que apresenta o óxido de manganês em um processo de redução é a alternativa A. A alternativa D apresenta um íon de Mn2+ sofrendo um processo de redução, mas este íon não está presente na pilha (o Manganês no óxido de manganês apresenta carga +4).
Questão 2
Uma pilha é construída usando magnésio (Mg) e prata (Ag), com os íons Mg2+ e Ag+ em solução. Sabendo que:
Mg2+ + 2e⁻ → Mg (E° = –2,37 V)
Ag+ + e⁻ → Ag (E° = +0,80 V)
Qual espécie atua como agente oxidante nessa pilha e qual o potencial padrão da pilha?
a) Mg2+, E0 = -3,17V
b) Mg2+, E0 = +3,17V
c) Ag+, E0 = -3,17V
d) Ag+, E0 = +3,17V
e) Ag, E0 = +3,17V
Resposta: alternativa D.
Para determinarmos quem é o agente oxidante, precisamos ter em mente que esta será a espécie que sofrerá redução. Assim, para sofrer redução, a espécie química precisa ter o maior potencial padrão de redução. Entre os casos da questão, o íon Ag+ é que apresenta maior potencial de redução (+0,80V), logo ele será a espécie que deve ser reduzida e também a espécie oxidante.
A reação global é formada pela soma de uma semi-reação de redução com uma de oxidação. Se o íon Ag+ sofre redução, o Mg metálico sofre oxidação, segundo as reações:
Veja também que o potencial fornecido na questão para a redução do magnésio é de -2,37V, porém como queremos a oxidação do magnésio, o sinal muda.
Somando os potenciais destas reações, chegamos em +3,17V
Questão 3
Em determinados materiais metálicos, há a presença de um outro metal conhecido como metal de sacrifício que fica em contato com o outro. Este metal recebe este nome, pois impede a corrosão do outro material, de forma que ele será corroído no lugar do outro.
Dentre as alternativas a seguir qual contém o requisito para a utilização de um metal como metal de sacrifício?
a) Um metal de sacrifício precisa ser menos reativo do que o metal a ser protegido
b) Um metal de sacrifício precisa ter potencial de redução mais alto do que o metal a ser protegido
c) Um metal de sacrifício precisa ser mais eletronegativo do que o metal a ser protegido
d) Um metal de sacrifício precisa ter potencial de oxidação maior que o metal a ser protegido
e) Um metal de sacrifício precisa ter potencial oxidante mais alto que o metal a ser protegido
Resposta: alternativa D.
Para um metal proteger o outro da corrosão (associada a oxidação) ele precisa oxidar no lugar do metal a ser protegido. Assim, se ele tiver um potencial de oxidação MAIOR do que o metal a ser protegido, ele irá oxidar antes, protegendo o outro metal da corrosão.
Questão 4
Em uma pilha são utilizados chumbo e prata metálicos, mergulhados em uma solução de seus íons. Assinale a representação correta desta pilha e o potencial padrão da pilha.
(Dados de E0red : Pb = -0,13V ; Ag = +0,80V)
a) Pb/Pb2+//Ag+/Ag , E0= +0,93V
b) Pb/Pb2+//Ag+/Ag , E0= -0,93V
c) Ag+/Ag//Pb/Pb2+, E0= +0,93V
d) Ag+/Ag//Pb/Pb2+, E0= -0,93V
e) Ag+/Ag//Pb/Pb2+, E0= +0,67V
Resposta: alternativa A.
A oxidação ocorre sempre no metal em que há menor potencial de redução, neste caso o chumbo. Assim, o chumbo sofrerá oxidação, enquanto a prata sofrerá redução. A representação correta de uma pilha apresenta, na ordem, sempre a oxidação primeiro e a redução em segundo:
Como os potenciais dados na questão são de redução, apenas o sinal do chumbo (que será oxidado) mudará. Então teremos +0,13V + 0,80V = +0,93V
Questão 5
Uma pilha eletroquímica composta por eletrodos de prata e magnésio mergulhados em soluções dos seus íons.
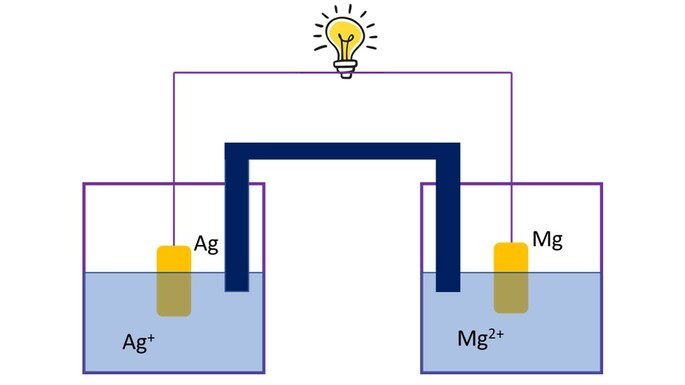
Sabendo que para acender uma lâmpada de LED são necessários aproximadamente 12V, e que os potenciais de redução para prata e magnésio são, respectivamente, +0,80V e -2,37V, determine quantas pilhas desta, associadas em série, seriam necessárias para acender o LED.
a) 1
b) 2
c) 3
d) 4
e) 5
Resposta: alternativa D.
A prata apresenta um potencial de redução maior, então sofrerá redução, enquanto o magnésio sofrerá oxidação. Como o potencial de redução do magnésio é -2,37V, o seu potencial de oxidação será +2,37V. Somando os potenciais de redução da prata com o de oxidação do magnésio, teremos +0,80V + 2,37V = +3,17V. Este potencial corresponde a apenas 1 pilha.
Como uma lâmpada necessita de 12V, podemos dividir essa voltagem pela voltagem de 1 pilha:
Como não é possível utilizar um número decimal de pilhas, arredondamos para 4.
Questão 6
Leia também: Eletroquímica: resumo, pilhas, eletrólise e exercícios
Confira mais exercícios de química para 2º ano do ensino médio (com respostas explicadas)
Exercícios sobre pilhas (com gabarito resolvido). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-pilhas-eletroquimicas/. Acesso em:

