Exercícios sobre as reações endotérmicas e exotérmicas
As reações químicas envolvem trocas de energia com o meio, e entender se um processo é endotérmico ou exotérmico é essencial para compreender fenômenos naturais, processos industriais e até reações que ocorrem no nosso corpo. Nesta lista de exercícios comentados, você poderá revisar conceitos-chave como variação de entalpia, absorção e liberação de calor, além de analisar exemplos práticos. Resolva as questões e confira as respostas explicadas.
Questão 1
Assinale a alternativa correta.
a) Reações endotérmicas apresentam .
b) Em reações exotérmicas a entalpia dos produtos é maior do que a dos reagentes.
c) Nem todas as reações com são endotérmicas.
d) Toda reação exotérmica apresenta .
e) Uma reação exotérmica feita em um recipiente deixaria as paredes do recipiente frias.
Resposta: alternativa D.
Reações exotérmicas sempre terão e, consequentemente, os produtos terão energia menor do que os reagentes. Já as reações endotérmicas apresentam
e os produtos terão energia maior do que os reagentes.
Questão 2
A reação de fotossíntese é responsável pela formação de glicose nos vegetais a partir de gás carbônico e água. Se sabe que os vegetais necessitam de luz solar para a ocorrência dessa reação. Baseado nesse fato, assinale a alternativa correta.
a) A reação de fotossíntese é endotérmica.
b) A reação de fotossíntese é exotérmica.
c) A quantidade de água na reação de fotossíntese é irrelevante para a energia envolvida neste processo.
d) A reação de fotossíntese tem , pois só necessita de água e gás carbônico.
e) A combustão da glicose poderia representar a fotossíntese.
Resposta: alternativa A.
A reação da fotossíntese só ocorre se houver luz solar, pois a luz fornece a energia necessária para a ocorrência da reação. Assim, podemos inferir que essa reação é endotérmica.
Questão 3
Complete as lacunas.
Reações com , ___________ energia. Assim, são conhecidas como reações _______________. Além disso, os reagentes terão energia __________ do que os produtos. Já as reações _________________ exibem características opostas a essas.
a) Absorvem, exotérmicas, menor, endotérmicas
b) Absorvem, endotérmicas, maior, exotérmicas
c) Liberam, endotérmicas, maior, endotérmicas
d) Absorvem, endotérmicas, menor, exotérmicas
e) Liberam, exotérmicas, menor, endotérmicas
Resposta: alternativa D.
Reações com sempre serão endotérmicas. Assim, os reagentes absorvem energia para formar os produtos, adquirindo maior energia. As reações exotérmicas apresentam características contrárias, portanto reagentes liberam energia formando produtos com menor energia.
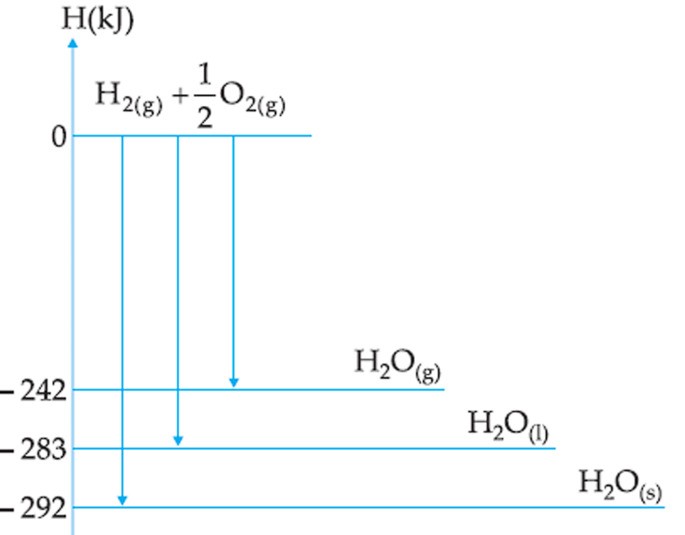
Utilize o gráfico a seguir para responder às questões 4 e 5.
Questão 4
Baseado no gráfico, assinale a alternativa correta.
a) A formação da água gasosa é um processo exotérmico.
b) A formação da água gasosa a partir da água líquida absorve 41kJ de energia.
c) A fusão da água tem entalpia -9kJ.
d) A decomposição da água líquida absorve mais energia do que a decomposição da água sólida.
e) A evaporação da água absorve menos energia do que a sua fusão.
Resposta: alternativa B.
As setas do gráfico indicam que os processos estão no sentido exotérmico, ou seja, de liberação de energia, pois estão apontado para baixo. Assim, o sentido contrário representa os processos endotérmicos. Vale lembrar que a diferença de entalpia entre os níveis não depende do sentido do processo. Desse modo, a diferença entre a água gasosa e a água líquida é de 41kJ e, como se trata da transformação de um líquido em um gás, estamos tratando de um processo endotérmico (absorção de energia).
Questão 5
Transformações físicas também são processos que estão associados com entalpia. Assim, podemos tratar de entalpia, não só em processos químicos. Baseado nessa informação, processos de condensação e sublimação são processos:
a) exotérmico e endotérmico, respectivamente.
b) exotérmico e exotérmico.
c) endotérmico e exotérmico, respectivamente.
d) endotérmico e endotérmico.
e) têm variação de entalpa igual a zero.
Resposta: alternativa A.
Um processo de condesação fala sobre a transformação de gás em líquido. Este processo é exotérmico, pois as moléculas gasosas perdem energia para se transformarem em líquido. Já a sublimação é o processo de transformação de sólido diretamente em gás, ou seja, necessita absorver energia (processo endotérmico).
Questão 6
Quimicamente falando, quando queremos quebrar uma ligação química, seja ela fraca ou forte, a molécula precisa absorver energia. Quando queremos formar uma nova ligação química, seja ela fraca ou forte, a sua formação acaba liberando energia. A força da ligação está associada com o quanto de energia este processo irá ocorrer.
Baseado nessas informações, assinale a alternativa que representa melhor uma reação em que ligações mais fortes são formadas a partir de moléculas com ligações mais fracas.
a) Esta reação será endotérmica.
b) Esta reação será exotérmica.
c) Não é possível afirmar com precisão se a reação será endotérmica, mas é mais provável que assim seja.
d) Não é possível afirmar com precisão se a reação será exotérmica, mas é mais provável que assim seja.
e) Esta reação pode ser exotérmica ou endotérmica, com a mesma probabilidade de ocorrer para ambas as situações.
Resposta: alternativa B.
Como as ligações formadas são mais fortes, a reação libera muita energia neste processo. Já como as ligações quebradas são mais fracas, a reação absorve pouca energia neste processo. Assim, é possível afirmar com certeza que essa reação irá liberar mais energia do que absorver, portanto será exotérmica.
Questão 7
Processo de dissolução de sais envolvem um tipo de entalpia conhecida como entalpia de dissolução. Esse processo é o somatório de outros dois processos: entalpia reticular (endotérmico) e entalpia de hidratação (exotérmico). A entalpia reticular está associada com a força das ligações iônicas existentes no sal. Quanto mais fortes, maior a energia reticular. Já a entalpia de hidratação está associada com o tamanho do íon solvatado e com a sua carga. Íons menores e com cargas maiores geram entalpias de hidratação maiores.
Assim, assinale a alternativa que apresenta a substância iônica com entalpia de dissolução mais próximo de um processo endotérmico possível (considere que a entalpia reticular não muda muito de uma substância para outra).
a) LiCl
b) NaCl
c) KCl
d) RbCl
e) CsCl
Resposta: alternativa E.
Como apenas os íons metálicos estão mudando de uma alternativa para a outra e que estes íons têm a mesma carga, pois são da família 1A da tabela periódica, precisamos identificar qual é o maior (neste caso o Cs+). Assim, este íon ao ser hidratado irá liberar pouca energia. Portanto, o seu processo de dissolução irá se aproximar mais de endotérmico do que dos outros íons.
Para estudar mais: Reações endotérmicas e exotérmicas: diferenças e exemplos
Exercícios sobre as reações endotérmicas e exotérmicas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-as-reacoes-endotermicas-e-exotermicas/. Acesso em: