Exercícios sobre a força dos ácidos (com gabarito explicado)
A força dos ácidos é um dos temas centrais da Química, fundamental para compreender fenômenos que vão desde reações industriais até processos biológicos.
Neste material, você encontrará exercícios comentados sobre a força dos ácidos, abordando critérios de comparação, ionização, estabilidade da base conjugada e aplicações práticas. Cada questão vem acompanhada de gabarito explicado para facilitar a aprendizagem e ajudar na preparação para provas e vestibulares.
Questão 1
Um operador de uma indústria química precisa identificar um ácido forte para um processo de limpeza. Ele deve priorizar análises físico-químicas de fácil realização e métodos de análise diretos. Seguindo a definição de Arrhenius, qual característica ele deve priorizar na escolha do produto?
a) condutividade elétrica da solução
b) temperatura da solução após a dissolução do ácido
c) concentração do ácido protonado na solução
d) solubilidade do ácido na água
Resposta: alternativa A.
ácidos de Arrhenius liberam H+ em solução aquosa. A força de um ácido está associada a qual proporção de ácido será convertida em H+. Assim, quanto maior a concentração de H+, mais forte é o ácido e maior será a condutividade dessa solução.
Questão 2
Um estudante, ao dissolver o composto que está com o rótulo rasgado, identificando apenas a presença de Hidrogênio na fórmula molecular, observa que a solução resultante conduz muito bem a eletricidade. Em testes posteriores ele identificou que a solução também apresentava pH=2. Baseado nessas análises, podemos afirmar que a substância se trata:
a) de uma base forte
b) de um ácido forte
c) de uma substância que se dissolve sem sofrer ionização
d) de uma substância que se dissocia muito bem
Resposta: alternativa B.
A substância em questão, trata-se de um ácido forte e, como todo ácido de Arrhenius, deve sofrer IONIZAÇÃO (não dissociação, como é o caso de compostos iônicos) formando H+. Por ser um ácido forte, ele libera uma grande quantidade de íons, responsáveis pela facilidade de conduzir eletricidade.
Questão 3
Um técnico de laboratório encontrou 4 soluções de iguais concentrações dos seguintes ácidos:
HClO, HClO2, HClO3, HClO4
Foi-lhe incubida a tarefa de organizá-los em estantes de reagentes em ordem crescente de acidez. Assim, a alternativa que melhor representa a ordem com que ele deve realizar essa organização é:
a) HClO4, HClO3, HClO2, HClO
b) HClO2, HClO3, HClO4, HClO
c) HClO4, HClO3, HClO, HClO2
d) HClO, HClO2, HClO3, HClO4
Resposta: alternativa D.
Para saber se um ácido será forte ou fraco, devemos subtrair o número de hidrogênios ionizáveis, do número de oxigênios deste ácido. Assim, quanto menos hidrogênios e mais oxigênios, mais forte será o ácido.
Questão 4
O ácido fluorídrico (HF) é utilizado para gravar vidros, enquanto o ácido clorídrico (HCl) é usado na limpeza de superfícies. Apesar de ambos serem ácidos, o HF requer manuseio mais cauteloso devido à sua alta toxicidade e capacidade de penetração tissular. No entanto, em solução aquosa e na mesma concentração, o HCl apresenta menor pH.
Essa diferença no pH é explicada pelo fato de que:
a) O HF é um ácido forte e se ioniza completamente na água.
b) O HF é um ácido fraco/moderado, com menor constante de ionização (Ka) que o HCl.
c) O HCl possui mais átomos de hidrogênio ionizáveis por molécula.
d) O HF reage com o dióxido de silício do vidro, tornando-o mais fraco em água.
e) O HCl é um ácido orgânico, menos reativo que os ácidos inorgânicos.
Resposta: alternativa B.
A constante de ionização é um indicador quantitativo do nível de acidez de uma substância e, quanto maior seu valor, mais forte é o ácido. Assim, a única explicação para soluções de mesma concentração de cada um destes ácidos apresentarem pH diferentes, é que o HCl é um ácido mais forte do que o HF.
Questão 5
Um agricultor precisa corrigir a acidez do solo de sua plantação. Ele possui quatro ácidos em seu galpão: acético (CH3COOH), sulfúrico (H2SO4), fosfórico (H3PO4) e cianídrico (HCN). Para obter a maior quantidade de íons H+ por mol de ácido adicionado ao solo, ele deve escolher o:
a) Ácido acético, por ser orgânico e menos agressivo ao solo.
b) Ácido sulfúrico, por ser um ácido forte e diprótico
c) Ácido fosfórico, por ter três hidrogênios ionizáveis.
d) Ácido cianídrico, por ser volátil e evaporar rapidamente.
e) Ácido acético, por ser o mais fraco e liberar H⁺ lentamente.
Resposta: alternativa B.
Como o ácido sulfúrico é um ácido sabidamente forte, significa que praticamente todas as suas moléculas ionizarão formando H+. Assim, comparativamente aos outros ácidos, para uma mesma concentração de ácido, ele irá liberar mais íons H+.
Questão 6
As constantes de ionização do ácido fosfórico (H3PO4) são Ka1=7,5.10-3, Ka2=6,2.10-8 e Ka3=3,6.10-13, para seus 3 hidrogênios, respectivamente.
Baseado nesse valores, indique nas alternativas a seguir aquela que contém a espécie fosforada mais ácida e a menos ácida, respectivamente:
a) H3PO4, HPO42-
b) HPO42-, H3PO4
c) PO43-, H3PO4
d) H3PO4, PO43-
Resposta: alternativa D.
A constante Ka1 corresponde à primeira ionização do ácido fosfórico. Perceba que esta é a maior constante e, portanto, a que indica a espécie mais ácida: o H3PO4.
A espécie FOSFORADA menos ácida é aquela que não terá hidrogênios ionizáveis, ou seja, o ânion fosfato (PO43-)
Questão 7
A acidez de uma substância está relacionada com diversos fatores moleculares e físico-químicos como número de hidrogênios, número de oxigênios, constante de ionização, eletronegatividade dos átomos constituintes, etc. Outro fator importante é o de estabilidade da base conjugada do ácido. Quanto mais estável for a base conjugada, mais forte é o ácido. Uma das formas de estabilizar a base conjugada de um oxiácido, é adicionando oxigênios ao átomo central. Assim, quando um H+ é liberado, o oxigênio onde estava ligado este H+ entra em ressonância com o outro oxigênio:
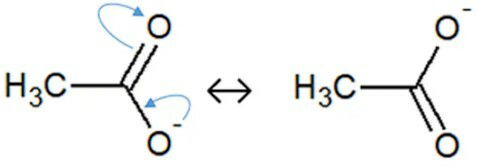
Em uma prova de Química, o professor Alexandre colocou 4 alternativas contendo estruturas de ácidos e pediu que seus alunos assinalassem a espécie mais básica. Assinale aquela que deve ser considerada como correta:
a) 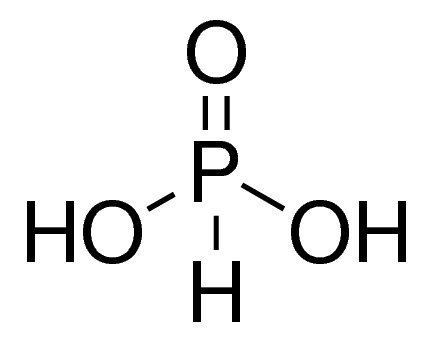
b) 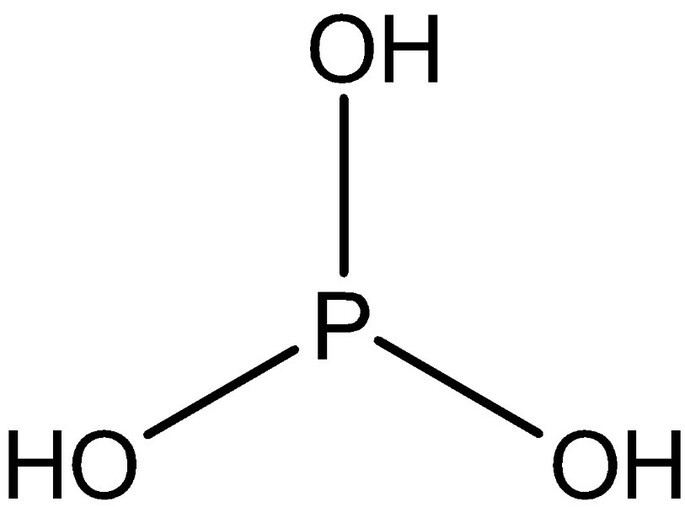
c) 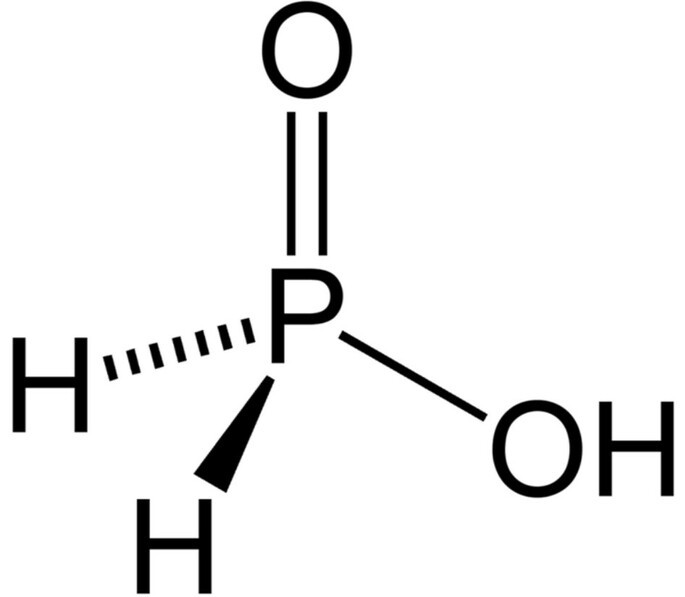
d) 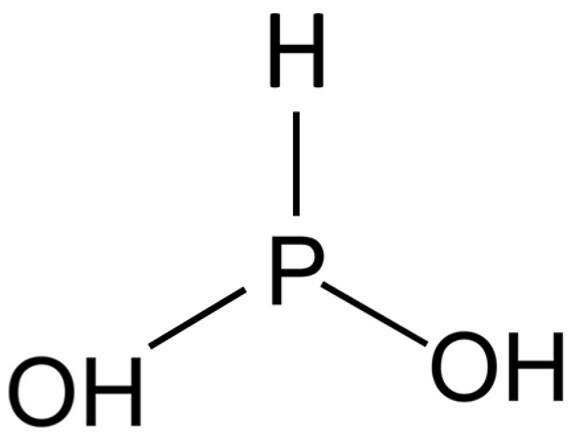
Resposta: alternativa D.
Aquela que será mais básica, será a menos ácida. A menos ácida é aquela com menos hidrogênios ionizáveis e com a base conjugada menos estável. Considerando as estruturas moleculares, hidrogênios ionizáveis são aqueles ligados a oxigênio. As alternativa que apresentam as estrutura com menos hidrogênios ligados a oxigênios são da alternativa A, C e D.
Na A, há 2 hidrogênios ionizáveis e 1 átomo de oxigênio no átomo central que estabiliza a base conjugada. Assim, essa alternativa pode ser descartada devido sua acidez relativa ser mais alta.
No item C, há apenas 1 hidrogênio ionizável. No entanto, ao sair este hidrogênio, a base conjugada formada terá muito mais estabilidade por conta da ressonância, se comparada à estrutura do item D que não apresenta nenhum oxigênio solitário no átomo central para gerar ressonância. Logo, a estrutura do item D é menos ácida e, portanto, mais básica.
Estude mais sobre os ácidos e continue testando seus conhecimentos com exercício sobre ácidos (com respostas resolvidas e explicadas).
Exercícios sobre a força dos ácidos (com gabarito explicado). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-a-forca-dos-acidos-com-gabarito-explicado/. Acesso em:

