Exercício sobre polaridade das moléculas (com gabarito resolvido)
A polaridade de uma molécula depende da eletronegatividade dos átomos constituintes e da sua geometria.
Se todas as ligações são apolares, qualquer que seja a geometria, a molécula é apolar. Se existem ligações polares, a molécula pode ser polar ou apolar.
Como identificar:
- Localize o centro de cargas positivas
- Localize o centro de cargas negativas
- Se os dois centros se anulam, a molécula é apolar. Se os dois centros não se anulam, a molécula é polar.
Desenvolva seus conhecimentos sobre esse tema com as questões a seguir.
Questão 1
Considerando as moléculas de H2 e HCl e suas polaridades, assinale a alternativa correta:
a) Ambas as moléculas são polares, pois possuem ligações covalentes polares.
b) O H2 é polar, enquanto o HCl é apolar devido à sua ligação simples.
c) O H2 é apolar, enquanto o HCl é polar devido à diferença de eletronegatividade entre seus átomos.
d) O H2 e o HCl são apolares, pois possuem ligações covalentes.
e) Ambas as moléculas são apolares, pois seus átomos possuem eletronegatividades idênticas.
Gabarito: c) O H2 é apolar, enquanto o HCl é polar devido à diferença de eletronegatividade entre seus átomos.
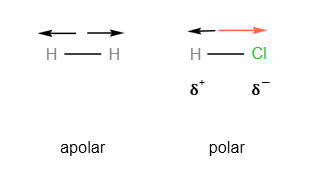
Na molécula de H2, os dois átomos, sendo idênticos, possuem a mesma eletronegatividade. Isso resulta em uma distribuição simétrica das cargas, tornando a molécula apolar.
Já na molécula de HCl, os átomos possuem eletronegatividades diferentes. O cloro, por ser mais eletronegativo, atrai o par eletrônico para mais perto de si, criando uma separação de cargas e tornando a molécula polar.
Questão 2
A polaridade de uma molécula depende da eletronegatividade dos átomos e de sua geometria molecular. Com base nisso, analise as moléculas de CO2 e H2O e assinale a alternativa correta:
a) Ambas as moléculas são polares, pois possuem átomos com eletronegatividades diferentes.
b) O CO2 é polar, enquanto a H2O é apolar devido à presença de ligações covalentes.
c) O CO2 é apolar, enquanto a H2O é polar devido ao seu formato angular.
d) O CO2 e a H2O são apolares, pois suas ligações são covalentes.
e) Ambas as moléculas são apolares, pois possuem uma distribuição simétrica de cargas.
Gabarito: c) O CO2 é apolar, enquanto a H2O é polar devido ao seu formato angular.
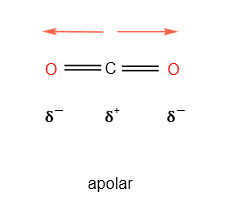
A molécula de CO2 tem duas ligações polares, pois o oxigênio é mais eletronegativo do que o carbono.
Como a molécula é linear, a atração do oxigênio “da esquerda” é contrabalanceada pela atração do oxigênio “da direita” e como resultado temos a molécula apolar.
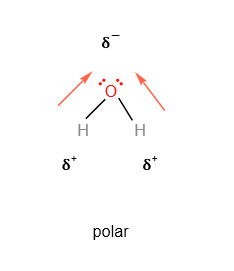
A molécula da água tem duas ligações polares, pois o oxigênio é mais eletronegativo do que o hidrogênio.
Na geometria angular da água, o lado dos hidrogênios é eletropositivo e o oxigênio eletronegativo. Como resultado temos a molécula polar.
Questão 3
A eletronegatividade é a capacidade de um átomo atrair elétrons em uma ligação química. Calcule a diferença de eletronegatividade das moléculas F2, HF e LiF e assinale a alternativa correta.
Dados dos valores de eletronegatividade:
F: 4,0
H: 2,1
Li: 1,0
a) A diferença de eletronegatividade do F2 é 4,0 e é uma molécula apolar.
b) A diferença de eletronegatividade do HF é 1,9 e é uma molécula polar.
c) A diferença de eletronegatividade do LiF é 2,0 e é uma molécula apolar.
d) A diferença de eletronegatividade do HF é 1,0 e é uma molécula apolar.
e) A diferença de eletronegatividade do F2 é 2,0 e é uma molécula polar.
Gabarito: b) A diferença de eletronegatividade do HF é 1,9 e é uma molécula polar.
A molécula do F2
F–F
4,0 - 4,0 = 0 → apolar
A molécula HF
H–F
4,0 - 2,1 = 1,9 → polar
A molécula do LiF
Li–F
4,0 - 1,0 = 3,0 → polar
Questão 4
O cloro, pertencente ao grupo dos halogênios, é um dos elementos mais eletronegativos da Tabela Periódica. A polaridade de uma ligação covalente pode ser determinada pela diferença de eletronegatividade entre os átomos envolvidos.
Considere a seguinte tabela com valores de eletronegatividade:
| Elemento | Eletronegatividade |
|---|---|
| Boro (B) | 2,0 |
| Carbono (C) | 2,5 |
| Fósforo (P) | 2,1 |
| Cloro (Cl) | 3,0 |
Com base nesses dados, calcule a diferença de eletronegatividade nas ligações B–Cl, C–Cl e P–Cl e identifique qual delas é a mais polar.
a) A diferença de eletronegatividade do B–Cl é 1,0 e é a ligação menos polar.
b) A diferença de eletronegatividade do P–Cl é 0,9 e é a ligação mais polar.
c) A diferença de eletronegatividade do C–Cl é 1,0 e é mais polar que a ligação P–Cl.
d) A diferença de eletronegatividade do B–Cl é 1,0 e é mais polar que a ligação C–Cl.
Gabarito: d) A diferença de eletronegatividade do B–Cl é 1,0 e é mais polar que a ligação C–Cl.
Calculando a diferenças de eletronegatividades, temos:
B–Cl
2,0 - 3,0 = 1,0
C–Cl
2,5 - 3,0 = 0,5
P–Cl
2,1 - 3,0 = 0,9
Em sequência crescente de eletronegatividade: C–Cl < P–Cl < B–Cl
Questão 5
A polaridade das moléculas é determinada pela diferença de eletronegatividade entre os átomos e pela geometria molecular. Com base nesses critérios, classifique as seguintes moléculas em polares e apolares:
N2, HI, NH3, CS2, CH4, CHCl3
Assinale a alternativa que apresenta corretamente a divisão entre moléculas polares e apolares:
a) Polares: N2, HI, NH3 | Apolares: CS2, CH4, CHCl3
b) Polares: HI, NH3, CHCl3 | Apolares: N2, CS2, CH4
c) Polares: NH3, CH4, CS2 | Apolares: N2, HI, CHCl3
d) Polares: N2, CHCl3, CH4 | Apolares: HI, NH3, CS2
e) Polares: N2, HI, CHCl3 | Apolares: NH3, CS2, CH4
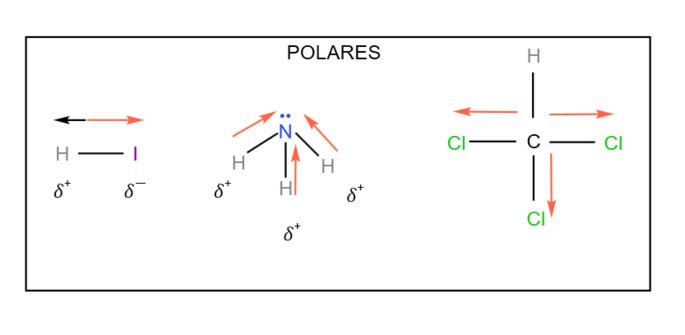
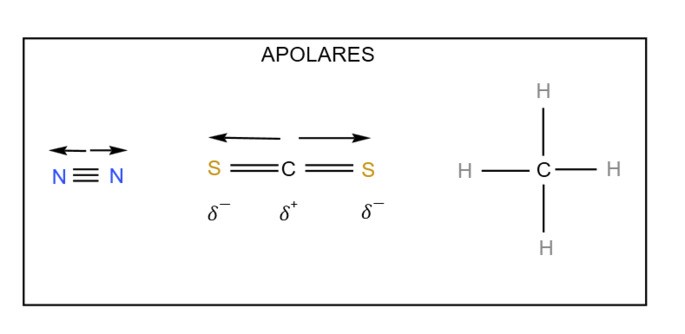
Gabarito: b) Polares: HI, NH3, CHCl3 | Apolares: N2, CS2, CH4
Observe as estruturas abaixo para melhor compreensão.
Questão 6
Leia também Polaridade das moléculas e Polaridade das ligações.
Para mais exercícios:
Exercícios sobre geometria molecular (com gabarito comentado)
Exercícios de ligações químicas (com respostas explicadas)
Exercício sobre forças intermoleculares (com respostas explicadas)
Exercício sobre polaridade das moléculas (com gabarito resolvido). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicio-sobre-polaridade-das-moleculas-com-gabarito-resolvido/. Acesso em:

