Entalpia de formação: o que é e como calcular (com exemplos e exercícios)
Quando se fala em entalpia de formação, estamos nos referindo a uma energia que está "armazenada" em uma substância química. Dessa forma, se seu professor te falar que a entalpia de formação da água é -285kJ/mol, ele está te dizendo que essa é a energia correspondente a 1 mol de água, mesmo que este valor seja negativo.
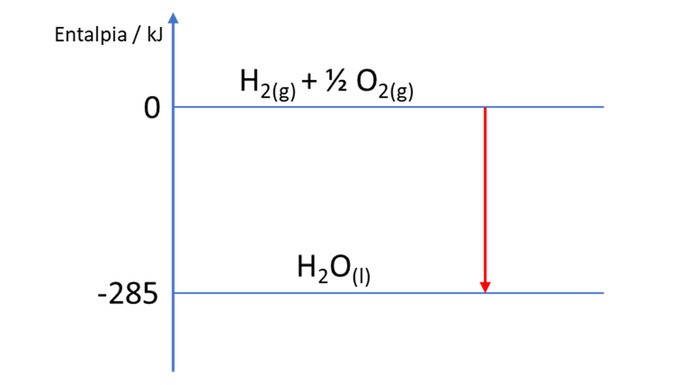
Para entender de onde vem este valor, precisamos inserir o conceito de reação de formação das substâncias. Reações de formação são reações químicas em que queremos formar 1 mol de uma determinada substância, a partir dos seus elementos na forma mais estável na natureza (também conhecido como alotropia). Por exemplo, a reação de formação da água (H2O) é:
Veja que a água é composta por 2 elementos: o hidrogênio (H) e o oxigênio (O). Desse modo, é preciso reagir os componentes mais comuns de cada um destes elementos, ou seja, o gás hidrogênio (H2) e o gás oxigênio (O2).
Veja também que, obrigatoriamente, deve-se formar 1 mol de H2O, portanto, o balanceamento correto para estas reações pode conter sempre números fracionários.
Graficamente, temos para essa reação:
Algumas substâncias na forma alotrópica mais estável são:
| Elemento | Alótropo mais estável |
| Carbono | Carbono grafite (Cgraf) |
| Nitrogênio | Gás nitrogênio (N2) |
| Fósforo | Fósforo vermelho (Pn) |
| Oxigênio | Gás oxigênio (O2) |
| Enxofre | Enxofre rômbico (S8) |
| Flúor | Gás flúor (F2) |
| Cloro | Gás cloro (Cl2) |
Veja outros exemplos de reações de formação:
Como calcular a entalpia de formação
Sabemos também que para calcular a variação de entalpia de uma reação, sempre fazemos a subtração da soma das entalpias dos PRODUTOS com a soma das entalpias dos REAGENTES:
(soma das entalpias também pode ser representada por Σ)
Mas um detalhe muito importante é que substâncias simples (formadas por apenas 1 tipo de elemento) na forma alotrópica mais estável apresentam entalpia igual a ZERO. Assim, calculando as entalpias das reações apresentadas anteriormente, teremos:
Ao valor de ΔH destas reações, damos o nome de ΔH de formação. Perceba que estes valores são iguais à entalpia da substância formada e é por isso que dizemos que este valor de ΔH corresponde a uma substância. Como em geral estas reações de formação são exotérmicas (LIBERAM energia), os valores de ΔH são negativos (há poucas exceções).
Desse modo, a definição de entalpia de formação tomou como referencial zero, todas as substâncias simples na forma alotrópica mais estável, facilitando a análise quantitativa de energia das reações químicas.
Exemplos e aplicações
Quando queremos saber se uma reação está liberando ou absorvendo energia, precisamos saber o seu valor de ΔH. Este valor irá indicar qual a energia que está associada a esta reação. Assim, valores negativos indicam liberação de energia e valores positivos indicam absorção de energia.
Para o cálculo de entalpia de uma reação podemos conhecer as entalpias de formação das substâncias envolvidas e realizar os cálculos vistos anteriormente. Exemplo:
Calculando a entalpia da reação de fotossíntese a partir das entalpias de formação das substâncias:
Veja que o resultado positivo para o valor de ΔHr indica que esta reação precisa absorver energia. Ja sabemos também que os seres fotossintetizantes precisam, além de gás carbônico (CO2) e água (H2O), de luz solar, que é justamente a fonte dessa energia que deve ser absorvida.
Exercícios
Questão 1
Dadas as entalpias de formação das substâncias, calcule a entalpia da reação a seguir:
a) +176kJ
b) -176kJ
c) -88kJ
d) +88kJ
para calcular o valor do ΔHr utilizamos a fórmula:
Substituindo os valores de entalpia de formação de cada uma das substâncias, temos:
Questão 2
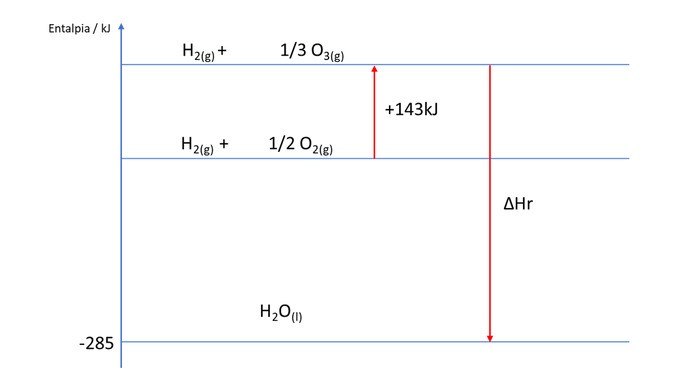
De acordo com o gráfico a seguir, determine a entalpia de reação da formação de H2O a partir do ozônio (O3)
a) -428kJ/mol
b) +142kJ/mol
c) -142kJ/mol
d) +428kJ/mol
Para calcular a entalpia da reação:
precisamos identificar pelo gráfico, onde está o "zero". Sabe-se que substâncias simples na forma alotrópica mais estável têm entalpia igual a zero. Assim, o nosso referencial zero é a linha do meio, correspodente a:
Graficamente, também podemos identificar que para chegarmos no nosso resultado, podemos somar as entalpias das reações:
Observe que no caso da primeira reação, o sinal do ΔH muda, pois a reação no gráfico está invertida. Já no caso da segunda reação, sabemos que se trata da reação de formação da água, portanto o valor de -285 corresponde também à diferença das entalpias no gráfico.
Sendo assim, o resultado é -143 - 285 = -428kJ/mol
Questão 3
Sabendo que a reação de combustão de 1 mol de etanol libera 1366kJ de energia, determine o ΔHf do etanol.
(Dados de ΔHf: H2O = -285kJ/mol ; CO2 = -393kJ/mol)
a) -678kJ/mol
b) +678kJ/mol
c) +275kJ/mol
d) -275kJ/mol
Para o cálculo, vamos utilizar a fórmula:
Substituindo os valores, temos:
Veja que, como a energia da reação é LIBERADA, o valor de 1366kJ deve ser negativo na equação. Como queremos descobrir a entalpia de formação do etanol, este será nosso valor de x. Lembre também que a entalpia de O2 é zero, pois se trata de uma substância simples na forma alotrópica mais estável.
Questão 4
Sabendo que a entalpia de formação de NH3 é -46,1kJ/mol, calcule a massa de NH3 necessária para que 207,4kJ de energia seja liberada na formação desta substância.
(Dados de massa atômica: N=14u ; H=1u)
a) 68g
b) 51g
c) 34g
d) 76,5g
Primeiro precisamos calcular a massa molar de NH3:
Assim, sabemos que 1 mol de NH3 tem 17g desta substância.
Sabemos também pelos dados da questão que 1 mol de NH3 liberam 46,1kJ de energia durante sua formação. Podemos então estabelecer uma regra de 3 relacionando massa de NH3 com energia liberada:
Continue praticando com exercícios sobre entalpia de formação (com questões respondidas e explicadas).
Ou siga os seus estudos:
Referências Bibliográficas
ATKINS, P.; PAULA, J. Físico-Química. 10. ed. Rio de Janeiro: LTC, 2018.
CASTELLAN, G. W. Fundamentos de Físico-Química. 1. ed. Rio de Janeiro: LTC, 2016.
LEVINE, I. N. Físico-Química. 6. ed. Porto Alegre: AMGH, 2012.
Entalpia de formação: o que é e como calcular (com exemplos e exercícios). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/entalpia-de-formacao-o-que-e-e-como-calcular/. Acesso em:

