Ametais: o que são e quais são na tabela periódica
Os ametais (ou não metais) são um grupo de elementos químicos com propriedades opostas, em sua maioria, às dos metais. Eles são fundamentais para a vida e para a formação da maioria das substâncias que nos rodeiam, como a água (H2O) e o gás carbônico (CO2).
Quais são os ametais
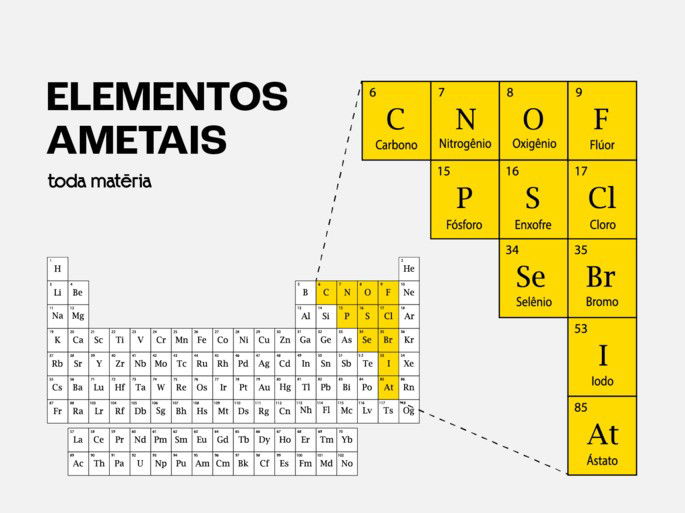
Dos 118 elementos conhecidos, apenas 13 são classificados como ametais. Eles estão localizados principalmente no lado direito da tabela periódica.
Aqui está a lista completa dos ametais, por grupo:
-
Grupo 14: Carbono (C)
-
Grupo 15 (Família do Nitrogênio): Nitrogênio (N), Fósforo (P)
-
Grupo 16 (Família do Oxigênio): Oxigênio (O), Enxofre (S), Selênio (Se)
-
Grupo 17 (Halogênios): Flúor (F), Cloro (Cl), Bromo (Br), Iodo (I), Astato (At)
-
Outros: Hidrogênio (H) - (Este elemento é único e não se encaixa perfeitamente em nenhum grupo, mas é classificado como ametal).
Para visualizar a localização exata desses elementos, consulte a tabela periódica abaixo, onde todos os ametais estão destacados pela borda vermelha:
Propriedades e características dos ametais
As propriedades dos ametais são, em geral, o oposto das dos metais.
Aparência: não são lustrosos (com brilho metálico). Podem ser coloridos (como o enxofre, que é amarelo) ou incolores (como os gases nobres).
Condutividade: são maus condutores de calor e eletricidade. O carbono, na forma de grafite, é uma exceção notável, pois é bom condutor de eletricidade.
Maleabilidade e ductilidade: são quebradiços no estado sólido. Se você golpear um pedaço de enxofre com um martelo, ele se partirá em pedaços, não se deformará como um metal.
Estados físicos à temperatura ambiente: apresentam grande variedade:
-
Gases: Hidrogênio (H2), Nitrogênio (N2), Oxigênio (O2), Flúor (F2), Cloro (Cl2) e todos os Gases Nobres.
-
Líquido: Bromo (Br2) é o único ametal líquido.
-
Sólidos: Carbono, Enxofre, Fósforo, Iodo, Selênio, etc.
Pontos de fusão e ebulição: geralmente baixos se comparados aos metais. Por exemplo, o nitrogênio funde a -210 °C. Exceções como o carbono (grafite), que tem ponto de fusão altíssimo, existem.
Eletronegatividade: tendem a ter alta eletronegatividade, especialmente os halogênios (o Flúor é o elemento mais eletronegativo). Isso significa que eles "atraem" os elétrons de uma ligação química com muita força.
Formação de íons: em reações químicas, os ametais tendem a ganhar elétrons para formar ânions (íons negativos). Ex: O oxigênio ganha 2 elétrons e vira O2-.
Diferenças entre metais e ametais
| Característica | Metais | Ametais |
| Aparência | Brilhosos | não brilhosos |
| Condutividade | bons condutores | maus condutores |
| Maleabilidade/ductilidade | maleáveis e dúcteis | quebradiços |
| Estado físico | sólidos (exceto mercúrio) | sólido, líquido e gasoso |
| Eletronegatividade | baixa | alta |
| Forma de íons | cátions | Ânions |
Importante: os semimetais
Entre os metais e os ametais, na tabela periódica, existe uma faixa de elementos com propriedades intermediárias, conhecidos como semimetais (ou metaloides), como o Silício (Si) e o Germânio (Ge). Eles podem se comportar como condutores ou isolantes dependendo das condições, sendo a base da eletrônica moderna.
Saiba mais sobre a Tabela Periódica e os metais.
Referências Bibliográficas
ATKINS, Peter; JONES, Loretta. Princípios de Química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2012.
SOCIEDADE BRASILEIRA DE QUÍMICA (SBQ). Tabela Periódica Online. [S. l], 2023. Disponível em: https://www.tabelaperiodica.org/. Acesso em: 23 set. 2025.
USBERCO, João; SALVADOR, Edgard. Química: volume único. 14. ed. São Paulo: Saraiva Educação, 2022.
Ametais: o que são e quais são na tabela periódica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/ametais-o-que-sao-e-quais-sao-na-tabela-periodica/. Acesso em:

