Ácido acético
O ácido acético, CH3COOH, cujo nome oficial é ácido etanoico, é um composto muito comum no nosso dia a dia, já que é o principal constituinte do vinagre.
Por isso, o nome do composto orgânico é ácido acético, derivado do latim acetum, que significa vinagre.
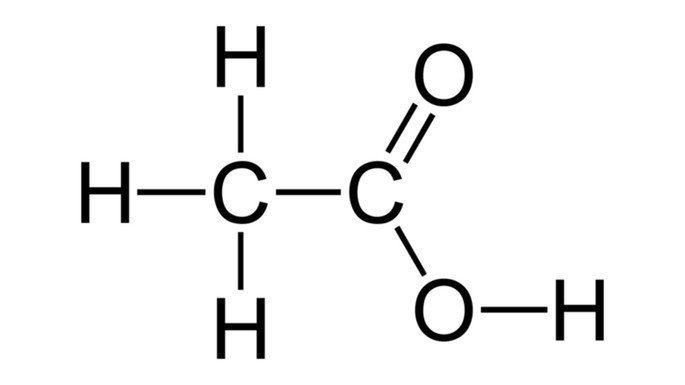
Fórmula do ácido acético
Principais aplicações do ácido acético
A principal e mais conhecida aplicação do ácido acético é para fabricação de vinagre, muito utilizado na culinária e na limpeza em geral. A composição química do vinagre corresponde a uma solução de 4 a 10% do ácido.
Diluições do ácido acético também são utilizadas para ação antibacteriana e anti-séptica, evitando o desenvolvimento de microrganismos.
O ácido acético é ainda utilizado como matéria-prima para produção de acetato de vinila, um precursor do plástico PVA.
A partir dele, os compostos anidrido acético e cloreto de acetila são produzidos para realização de sínteses orgânicas.
Ésteres de diversas aplicações, como solventes, essências e perfumes, são fabricados a partir do ácido. Assim como as fibras têxteis, produzidas pelo acetato de celulose, que também é utilizado na confecção de filmes fotográficos.
Você também pode se interessar porQuímica Orgânica.
Características do ácido acético
O ácido acético é um importante ácido carboxílico capaz de conduzir eletricidade em soluções aquosas e agir como indicador ácido-base ao mudar a cor de algumas substâncias.
Trata-se de um líquido incolor, de sabor azedo e forte cheiro característico. Em solução aquosa, o ácido acético está na sua forma ionizada, conforme a equação química a seguir.
Na sua forma pura, a substância recebe o nome de ácido acético glacial, um líquido incolor e corrosivo, que ao atingir seu ponto de fusão (16,7 ºC) adquire a aparência de gelo.
Por ser um ácido, esse composto químico tem facilidade em reagir com bases e produzir sais.
A força de um ácido é medida pela sua constante de ionização (Ka). Quanto maior o Ka, mais forte é o ácido. No caso do ácido acético, ele é um ácido fraco, pois seu Ka é 1,76 . 10-5, consequentemente, possui pKa 4,75.
Saiba mais sobre os ácidos carboxílicos.
Obtenção do ácido acético
O ácido acético foi o primeiro composto orgânico sintetizado. A realização desse feito ocorreu em em 1845 por Adolphe Wilhelm Hermann Kolbe (1818-1884).
A forma mais simples de obter o ácido acético é pela oxidação do álcool etílico ou etanol.
Essa reação é uma oxidação aeróbica produzida por bactérias dos gêneros Acetobacter e Clostridium acetobtylicum que ocorre, por exemplo, quando uma garrafa de vinho é deixada aberta. O ácido acético é que confere sabor azedo, fazendo o vinho azedar transformando-o em vinagre.
Para realizar essa reação em escala industrial são utilizados catalisadores para acelerar a reação, como o pentóxido de vanádio (V2O5).
A fermentação é o processo utilizado para fabricação do vinagre, uma solução de ácido acético. Para isso, são utilizados os fungos Mycoderma aceti para fermentar o etanol.
Outras formas de produzir o ácido acético é utilizando o álcool metanol como matéria-prima em uma reação chamada de carbonilação.
Também, são utilizados derivados do petróleo, como nafta e butano, que por meio de oxidação produzem o ácido acético.
Não pare por aqui, conheça outros ácidos.
BATISTA, Carolina. Ácido acético. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/acido-acetico/. Acesso em:


